Raport
Oznaczenie rozkładu rozmiarów, oszacowanie liczby oraz obrazowanie liposomów
Data: 06.10.2021
Autor
Raport przygotowała (RODO) z Katedry Inżynierii Biomedycznej Politechniki Wrocławskiej w ramach zamówienia dla firmy Botanical & Medicinal Research sp. z o.o. z dnia 23 września 2021 r.
Streszczenie
Zgodnie z zamówionym zleceniem, w ramach pracy określono rozkład rozmiarów liposomów techniką Dynamicznego Rozpraszania Światła (DLS), oszacowano liczebność liposomów na podstawie intensywności rozpraszanego światła oraz zobrazowano liposomy metodą mikroskopii krioelektronowej (cryo-TEM).
Na podstawie uzyskanych wyników zauważono, że w formulacji znajduje się jednorodna zawiesina cząstek o średnicy powyżej 100 nm (średni rozmiar wyznaczony techniką DLS – 164 nm, a metodą cryo-TEM – 112 nm). Dodatkowo, oszacowano, że w każdym mililitrze produktu znajduje się 4,09 ∙ 10^11 cząstek. Wyniki obrazowania mikroskopii krioelektronowej wskazują na budowę charakterystyczną dla liposomów typu LUV (ang. large unilamellar vesicle).
1. Metodologia
W pracy zbadano otrzymany produkt: (nr partii 0609) Do czasu pomiaru formulację przechowywano w lodówce (4°C).
Określenie rozkładu rozmiaru cząstek w produkcie
Rozkład rozmiarów cząstek produktu został wyznaczony metodą Dynamicznego Rozpraszania Światła (DLS), która opiera się na zależności pomiędzy wielkością cząstki a jej ruchami Browna. Ruch Browna jest wynikiem oddziaływania molekuł rozpuszczalnika na badaną cząstkę – wraz ze wzrostem rozmiaru cząstki jest ona mniej podatna na oddziaływania rozpuszczalnika. W efekcie, większe cząsteczki charakteryzują się wolniejszymi i mniejszymi amplitudami ruchu Browna w porównaniu do mniejszych cząstek.
Pomiar obejmuje oświetlenie próbki za pomocą lasera. Światło zostaje rozproszone na cząstkach co powoduje zmianę fazy wiązki laserowej oraz wywołuje interferencję, która jest rejestrowana jako ciemniejsze oraz jaśniejsze plamy, które odpowiadają wygaszeniu lub wzmocnieniu światła. Metoda DLS polega na rejestracji zmiany położenia jasnych lub ciemnych obszarów na podstawie zmiany intensywności światła, które odpowiadają ruchom Browna. Sygnał intensywności fluktuującego światła jest rejestrowana za pomocą cyfrowego autokoleratora, który porównuje podobieństwo sygnału w dwóch punktach czasowych: na początku rejestracji oraz dla kolejnych przesunięć czasowych. Rozmiar cząstek jest wyznaczony na podstawie utraty autokorelacji: fluktuacja małych cząstek jest szybsza, a więc autokorelacja zostaje utracona szybciej w porównaniu do dużych cząstek.
Zarejestrowana funkcja autokorelacji następnie zostaje przybliżona funkcją ekspotencjalną z określoną stałą czasową, która wraz z równaniem Stokesa-Einsteina zostaje wykorzystana do obliczenia rozmiaru cząstek w badanym produkcie [1].
Pomiary zostały przeprowadzone z wykorzystaniem urządzenia Malvern Zetasizer Nano ZS wyposażonego w laser o długości fali 532 nm. Model pozwala na ocenę rozkładu rozmiaru cząsteczek w zakresie 0,6 nm – 6 μm. Pomiar rozkładu rozmiaru cząsteczek przeprowadzono przy założeniu parametrów:
• Materiał: współczynnik załamania: 1,37, absorpcja: 0,02,
• Rozpuszczalnik: woda (temperatura 25ºC, lepkość 0,8872 cP, współczynnik załamania 1,330),
• Czas równowagi: 120 s,
• Wzmocnienie: 6.
Próbkę zmierzono 3-krotnie po 80x rozcieńczeniu wodą demineralizowaną.
Oszacowanie liczby liposomów
Intensywność rozproszonego światła rejestrowanego techniką DLS jest proporcjonalna do liczby cząstek w homogenicznej zawiesinie [2]. W efekcie metoda DLS jest wygodnym i prostym sposobem uzyskania informacji o koncentracji cząstek w próbce, jeśli dostępna jest próbka referencyjna o znanym stężeniu zgodnie z równaniem [3]:
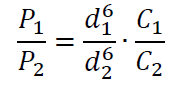
gdzie:
• P1 i P2 – współczynniki zliczania fotonów odpowiednio próbki referencyjnej i badanej [kcps],
• C1 i C2 – stężenie próbki referencyjnej i badanej [liczba cząstek/ml],
• d1 i d2 – średnica cząstek w próbce referencyjnej i badanej [nm].
Jako próbkę referencyjną wykorzystano komercyjny standard wielkości cząstek Nanobead NIST (Polyscience, Inc.) o rozmiarze 99,9 ± 1,3 nm i stężeniu 1,82∙ 1013 [cząstek/ml] (dane od producenta). Współczynnik zliczania fotonów określono za pomocą techniki DLS.
Obrazowanie liposomów
Obrazy cryo-TEM zebrano za pomocą mikroskopu Tecnai F20 X TWIN (FEI Company), wyposażonego w działo elektronowe z emisją polową (FEG) (działające w reżimie Schotty’ego), pracujący przy napięciu przyspieszającym 200 kV. Mikrofotografie zebrano za pomocą dolnej kamery CMOS Rio 16 (Gatan Inc.). Próbki przygotowano poprzez witryfikację roztworów naniesionych na miedzianą siatkę pokrytą filmem węglowym (Quantifoil R 2/2; Quantifoil Micro Tools GmbH). Przed użyciem siatki zostały poddane plazmowaniu (plasma cleaning) przez 15 sekund, przy użyciu Femto plasma cleaner (Diener Electronic). Następnie na siatkę została naniesiona kropla (3 μL) roztworu, nadmiar został odsączony, po czym próbka została bardzo szybko zanurzona w ciekłym etanie. Wykorzystano do tego w pełni zautomatyzowane urządzenie do witryfikacji Vitrobot Mark IV (FEI Company). Po przygotowaniu próbka była przechowywana w ciekłym azocie, do momentu umieszczenia jej w holderze kriogenicznym Gatan 626 (Gatan Inc.), a następnie wprowadzona do mikroskopu i analizowana w temperaturze -178 °C. Do pomiaru próbkę rozcieńczono 5krotnie wodą demineralizowaną.
2. Wyniki
Na Rysunku 1. pokazano rozkład rozmiarów cząstek w roztworze 1. próbki pomiarowej (każda próbka została zmierzona 3krotnie). W Tabeli 1. zebrano średni rozmiar liposomów trzech przygotowanych próbek oraz współczynnik polidyspersyjności (PDI). Na podstawie uzyskanych wyników zauważono, że produkt zawiera homogeniczną populację cząstek o średnim rozmiarze 164 nm oraz PDI – 0,21.
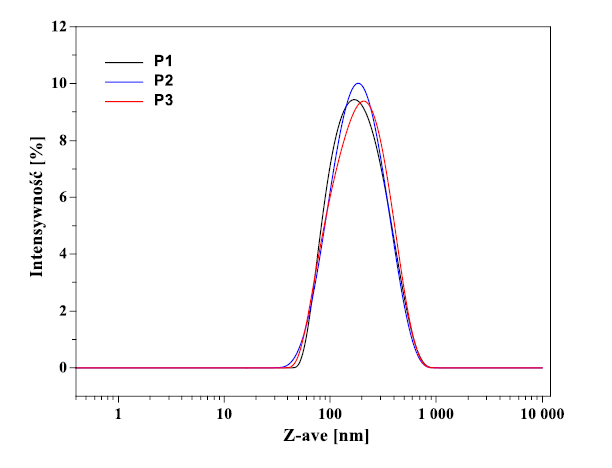
Rysunek 1. Rozkład rozmiarów cząstek w produkcie
Tabela 1. Średni rozmiar cząstek oraz współczynnik polidyspersyjności trzech próbek produktu

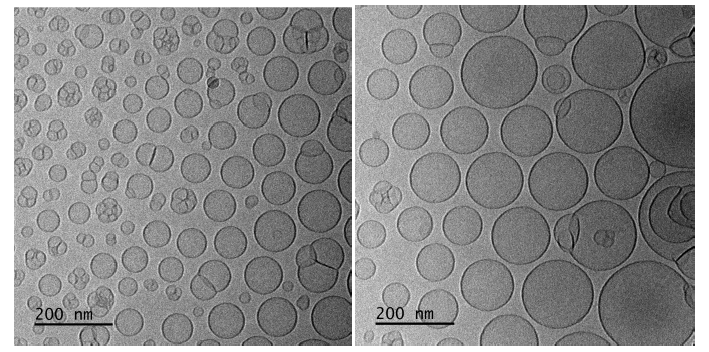
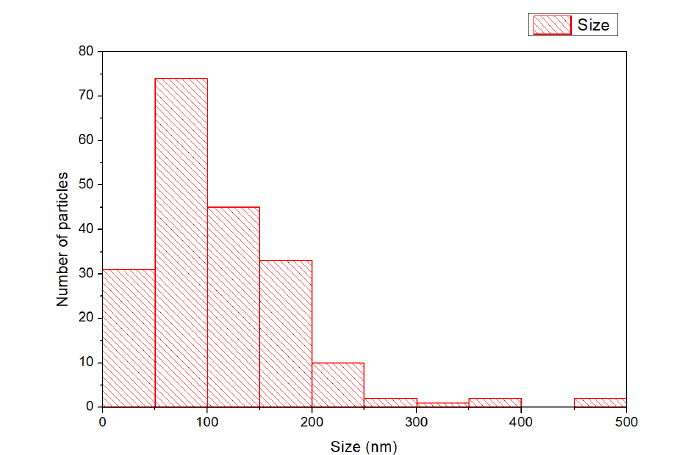
W ostatnim kroku zobrazowano próbkę metodą mikroskopii krioelektronowej. Na Rysunku 2. pokazano przykładowe dwa obrazy. Na ich podstawie zauważono, że przeważają sferyczne pęcherzyki w rozmiarach 20-500 nm o grubość membrany ~5 nm, czyli wartości charakterystyczne dla liposomów typu LUV (ang. large unilamellar vesicle). Średni rozmiar (dla 200 obiektów sferycznych): 112 nm. Rozkład rozmiarów pokazano na histogramie na Rysunku 3.
Rysunek 2. Zdjęcia uzyskane techniką cryo-TEM przedstawiające cząstki próbki po rozcieńczeniu 5 krotnym.
Rysunek 3. Rozkład rozmiarów liposomów wyznaczony techniką cryo-TEM
3. Literatura
[1] Goldburg WI (1999) Dynamic light scattering. American Journal of Physics 67(12): 1152-1160[2] Haiss W, Thanh NT, Aveyard J, Fernig DG (2007) Determination of size and concentration of gold nanoparticles from UV− Vis spectra. Analytical chemistry, 79(11): 4215-4221
[3] Shang J, Gao X (2014) Nanoparticle counting: towards accurate determination of the molar concentration. Chemical Society Reviews, 43(21): 7267-7278.
4. Dane surowe
https://drive.google.com/………….(własność Botanical & Medicinal Research sp. z o.o.)
Raport przygotowała:
(RODO)
Katedra Inżynierii Biomedycznej
Politechnika Wrocławska
link bezpośredni do raportu z przeprowadzonego badania:
https://botamed.com/wp-content/uploads/2023/07/Badanie-liposomow.pdf












